Хімія. Комплексна підготовка до ЗНО і ДПА
6.4. Будова молекули води. Водневий зв’язок між молекулами води
У молекулі води є два ковалентні полярні зв’язки між атомом Оксигену і двома атомами Гідрогену. Через велику різницю електронегативності Оксигену (3,5) і Гідрогену (2,2) електронні хмари зміщені в бік Оксигену, внаслідок чого молекула води являє собою диполь.
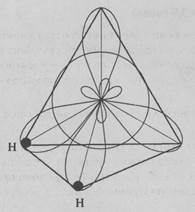
Унаслідок утворення молекули води відбувається sp3-гібридизація електронних орбіталей атома Оксигену. Дві sp3-орбіталі йдуть на утворення зв’язку з Гідрогеном. В атома Оксигену залишається ще дві sp3-орбіталі, заповнені спареними електронами.
Через нерівноцінність станів електронних хмар валентний кут зв’язків Н-О дещо відрізняється від тетраедричного і становить не 109,5°, а 104,5°:

Між молекулами води існують водневі зв’язки, завдяки яким молекули сполучаються між собою (у рідкому і твердому станах), утворюючи так звані кластери і клатрати (асоціати), які можна побачити за допомогою фазово-контрастного мікроскопа. Сила водневого зв’язку між молекулами води у 20 разів менша за силу ковалентного зв’язку Н-O у самій молекулі. Схема водневих зв’язків між молекулами води:

Цей контент створено завдяки Міністерству освіти і науки України
