Хімія. 9 клас. Попель
Цей підручник можна завантажити у PDF форматі на сайті тут.
§ 28. Карбонові кислоти. Оцтова (етанова) кислота
Матеріал параграфа допоможе вам:
- вирізняти карбонові кислоти серед інших органічних сполук;
- з'ясувати будову молекули оцтової кислоти;
- засвоїти властивості оцтової кислоти;
- дізнатися про застосування оцтової кислоти.
Карбонові кислоти. У цьому і наступному параграфах ітиметься про сполуки класу карбонових кислот. Вони відрізняються від спиртів наявністю в молекулах карбоксильної групи атомів
![]()
Карбонові кислоти — це похідні вуглеводнів, молекули яких містять одну або кілька карбоксильних груп.
У рослинному світі трапляються різні карбонові кислоти — мурашина, оцтова, щавлева, яблучна, лимонна та ін. Тривіальні назви цих сполук здебільшого походять від назв рослин, у яких вони були знайдені (мал. 78, а). Карбонові кислоти виявлено і в організмах комах (мал. 78, б), ссавців, людини.

Мал. 78. Виявлення кислот за допомогою універсального індикатора: а — у соку лимона; б — у виділеннях мурашок
Оцтова кислота. Рідину, назва якої — оцет, виготовляли люди ще в давні часи. Її використовують для різних потреб у кожній родині, передусім для консервування, під час приготування їжі (мал. 79). Оцет — розбавлений водний розчин оцтової кислоти.

Мал. 79. Оцет
Оцтова кислота є найважливішою карбоновою кислотою. Її хімічна формула — СН3СООН. Вона складається з двох частин — вуглеводневого залишку -СН3 (залишок від молекули метану СН4) і карбоксильної групи -СООН.
Хімічна назва оцтової кислоти — етанова кислота.
Будова молекули оцтової кислоти. Структурна формула молекули цієї сполуки (мал. 80):


Мал. 80. Кулестержнева модель молекули оцтової кислоти
Атом Оксигену, який сполучений з атомом Карбону подвійним зв'язком, спричиняє сильне зміщення спільної електронної пари в гідроксильній групі:
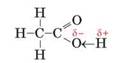
Зв'язок О-Н у молекулі оцтової кислоти є більш полярним, ніж у молекулах етанолу чи гліцерину, тому сполука виявляє кислотні властивості.
Фізичні властивості. За звичайних умов оцтова кислота є безбарвною рідиною з різким запахом і густиною 1,05 г/см3. При зниженні температури до +16,7 °С вона кристалізується, немов замерзає (мал. 81). Тому чисту кислоту іноді називають льодяною оцтовою кислотою. Температура кипіння сполуки +118,1 °С. Вона вища, ніж температура кипіння етанолу С2Н5ОН (+78,3 °С). Це зумовлено утворенням у кислоті більшої кількості водневих зв'язків (її молекула містить два атоми Оксигену, тоді як молекула спирту — один атом).

Мал. 81. Чиста оцтова кислота, яка зберігається в прохолодному приміщенні
Оцтова кислота змішується з водою в будь-яких співвідношеннях з утворенням розчину.
Хімічні властивості. Оцтова кислота, як і неорганічні кислоти, дисоціює у водному розчині на катіони Гідрогену та аніони кислотного залишку:
СН3СООН ⇄ Н+ + СН3СОО-.
Цей процес відбувається внаслідок розриву ковалентних полярних зв'язків О-Н. Утворювані катіони Гідрогену спричиняють зміну забарвлення індикатора.
Оцтова кислота є слабкою; в її розчині міститься значно більше молекул кислоти, ніж йонів.
Аніон СН3СОО- називають ацетат-іоном, а солі оцтової кислоти — ацетатами (етаноатами). У формулах солей цієї та інших органічних кислот спочатку записують аніони, потім — катіони: CH3COONa, (СН3СОО)2Ва.
Оцтова кислота взаємодіє з активними металами (з виділенням водню):
![]()
Вона також вступає в реакції з основними й амфотерними оксидами (мал. 82), основами, амфотерними гідроксидами, деякими солями слабких кислот (наприклад, із карбонатами):


Мал. 82. Реакція оцтової кислоти з купрум(ІІ) оксидом
У йонно-молекулярних рівняннях оцтову кислоту як слабку кислоту подають у недисоційованій формі:
CH3COOH + LiOH → CH3COOLi + H2O;
CH3COOH + OH- → CH3COO- + H2O.
• Складіть рівняння реакції оцтової кислоти з розчином натрій силікату в молекулярній та йонно-молекулярній формах.
Застосування. Оцтова кислота — перша з карбонових кислот, яка стала відома людині. Її застосовують у хімічній і харчовій промисловості, при фарбуванні тканин, у виробництві штучних волокон, домашньому господарстві.
ВИСНОВКИ
Карбонові кислоти — похідні вуглеводнів, молекули яких містять одну або кілька карбоксильних груп -СООН.
Оцтова кислота СН3СООН — найважливіша карбонова кислота. Це безбарвна рідина з різким запахом, яка змішується з водою в будь-яких співвідношеннях з утворенням розчину.
Оцтова кислота є слабкою. Вона взаємодіє з металами з виділенням водню, основними й амфотерними оксидами, основами, амфотерними гідроксидами, деякими солями.
Оцтову кислоту використовують у промисловості, для домашніх потреб.
- 205. Які сполуки називають карбоновими кислотами? Чим молекула карбонової кислоти відрізняється від молекули спирту?
- 206. Знайдіть формулу карбонової кислоти, якщо її молярна маса така сама, що й етанолу. Чи відповідає ця кислота визначенню карбонових кислот?
- 207. Поясніть, як і завдяки чому молекула оцтової кислоти дисоціює у водному розчині.
- 208. Чому оцтова кислота не виявляє основних властивостей, хоча її формула містить групу ОН, як і формула натрій гідроксиду?
- 209. Складіть рівняння реакцій і дайте назви їхнім продуктам:
а) СН3СООН + Li → ...;
в) СН3СООН + MnO → ...;
б) СН3СООН + Zn(OH)2 → ...;
г) СН3СООН + К2СО3 → ... .
- 210. Наведіть по два молекулярні рівняння, які відповідають таким йонно-молекулярним рівнянням:
а) Н+ + СН3СОО- = СН3СООН;
б) S2- + 2CH3COOH = H2S↑ + 2CH3COO-.
- 211. Обчисліть масову частку оцтової кислоти в розчині, який утворився:
а) при змішуванні однакових кількостей речовини кислоти і води;
б) при додаванні 20 г кислоти до 200 г 20 %-го її розчину;
в) при додаванні 100 г води до 200 г 20 %-го розчину кислоти.
- 212. Відносна формульна маса солі оцтової кислоти становить 142. Визначте формулу цієї солі й назвіть сполуку.
- 213. Обчисліть масу розчину калій гідроксиду з масовою часткою лугу 32 %, який витратили на нейтралізацію 50 г розчину оцтової кислоти з масовою часткою кислоти 12 %.
- 214. Які маси оцтової есенції та води потрібно взяти для приготування 160 г столового оцту — розчину оцтової кислоти з масовою часткою кислоти 9 %? Візьміть до уваги, що оцтова есенція є розчином, який містить 80 % оцтової кислоти за масою.
ДЛЯ ДОПИТЛИВИХ
Як добувають оцтову кислоту
Щорічний обсяг виробництва оцтової кислоти у світі сягає 4 млн тонн. Її добувають на заводах переважно з інших органічних сполук. Наприклад, за певних умов здійснюють реакцію н-бутану1 з киснем:
![]()
Лабораторний метод добування оцтової кислоти ґрунтується на реакції обміну між твердою сіллю цієї кислоти і концентрованою сульфатною кислотою. Взаємодію речовин здійснюють при нагріванні:
![]()
Пара оцтової кислоти, яка виділяється під час реакції, при охолодженні перетворюється на рідину.
Оцтова кислота утворюється при окисненні етанолу в його водному розчині киснем повітря за участю особливих бактерій. Реакція відбувається, якщо масова частка спирту в розчині не перевищує 10 %, і триває два-три тижні. Цей процес називають оцтовокислим бродінням. У такий спосіб (скисанням вина) в давнину виробляли оцет.
1 Короткі відомості про цю сполуку вміщено на с. 122.
Цей контент створено завдяки Міністерству освіти і науки України
