Підручник з Хімії. 9 клас. Григорович - Нова програма
Цей підручник можна завантажити у PDF форматі на сайті тут.
§ 8. Електроліти й неелектроліти. Електролітична дисоціація
Пригадайте: електричний струм — це спрямований рух заряджених частинок.
Поняття про електроліти
Наприкінці XIX століття було експериментально доведено, що розчини більшості неорганічних сполук, наприклад кухонної солі, соди, калійної селітри, добре проводять електричний струм. Такі речовини назвали електролітами. А чиста, точніше дистильована, вода й розчини багатьох органічних речовин, наприклад цукру, етилового спирту, не проводять струм — вони є неелектролітами (мал. 8.1). Багато солей, навіть нерозчинні у воді, наприклад барій сульфат, проводять електричний струм у розплавленому стані.

Мал. 8.1. Розчини кислоти, лугу та солі проводять електричний струм, а чиста вода — ні
Речовини, розчини або розплави яких проводять електричний струм, називають електролітами, а речовини, що не проводять струм ані в розчині, ані в розплаві, — неелектролітами.
Належність речовини до електролітів чи неелектролітів визначається типом її хімічного зв’язку. Електролітами є сполуки з йонним або дуже полярним ковалентним зв’язком, а неелектролітами є речовини з неполярним або слабополярним ковалентним зв’язком (схема 4).
Схема 4. Класифікація речовин на електроліти та неелектроліти

Електроліти мають велике значення в природі та житті людини. Вони містяться у складі всіх живих організмів, де забезпечують перебіг важливих процесів. Біологічні рідини організму людини являють собою розчини, що містять йони, на які розпадаються електроліти — солі, основи, кислоти. Різні йони виконують певну біологічну функцію: беруть участь у процесах живлення та виділення, передачі нервових імпульсів, скорочення м’язів. Без участі електролітів неможливе існування в розчинах молекул білків та ДНК, а отже, неможливим було б і життя на нашій планеті.
Електролітична дисоціація
Вам уже відомо, що в речовинах йонної будови, наприклад у кухонній солі, є заряджені частинки — йони. Ви також знаєте, що електричний струм — це спрямований рух заряджених частинок. Чому ж тверда кухонна сіль не проводить електричний струм, а її розчин чи розплав проводять? Відповідь на це питання дав шведський учений Сванте Арреніус. Він припустив, що деякі речовини (електроліти) під час розчинення у воді (або розплавлення) розпадаються на йони, що можуть вільно рухатися. У разі розплавляння частинки речовин стають рухливими (мал. 8.2, а), а в разі розчинення вони рівномірно розподілені у воді (мал. 8.2, б), тобто в обох випадках здатні вільно рухатися. Завдяки цьому розчини й розплави проводять електричний струм. Йони, що містяться у твердій кухонній солі, розташовані у вузлах кристалічних ґраток і переміщуватися не можуть, тому тверді електроліти електричний струм не проводять (мал. 8.2, в). У дистильованій воді йони відсутні, тому вона струм не проводить (мал. 8.2, г).

Мал. 8.2. У розчинах і розплавах електролітів йони вільно переміщуються, тому вони здатні проводити електричний струм: а — розплав кухонної солі; б — розчин кухонної солі; в — тверда кухонна сіль; г — чиста вода
Процес розпаду речовини на йони під час розчинення у воді або плавлення називають електролітичною дисоціацією.
Під час розчинення солей і основ (речовин йонної будови) у розчин переходять йони, що містяться в їхньому складі. Молекулярні речовини дисоціюють дещо по-іншому. Гідроген хлорид — це газ, що складається з полярних молекул HCl. Кожну молекулу, що потрапляє в розчин, одразу оточують диполі води, притягуючись до неї протилежно зарядженими боками. У результаті такої взаємодії полярний зв’язок у молекулі HCl перетворюється на йонний, а йони, що утворюються, переходять у розчин (мал. 8.3).

Мал. 8.3. Електролітична дисоціація гідроген хлориду
Кислоти — це електроліти з ковалентними полярними зв’язками. Тому дисоціювати на йони кислоти можуть тільки у водному розчині під дією молекул води. Чисті кислоти електричний струм не проводять.
Отже, головна відмінність електролітів від неелектролітів полягає в тому, що електроліти розпадаються (дисоціюють) на позитивно й негативно заряджені йони. Під дією електричного поля позитивно заряджені йони (катіони) спрямовано рухаються до негативного електрода (катода), а негативно заряджені йони (аніони) — до позитивного електрода (анода) (мал. 8.4). Ці висновки, зроблені Арреніусом, є основою сформульованої ним теорії електролітичної дисоціації.

Мал. 8.4. Рух йонів у розчині під дією електричного поля
Речовини або їхні суміші, що здатні проводити електричний струм, називають провідниками електричного струму. Їх поділяють на два типи: провідники I та II роду. Вони принципово відрізняються частинками, що є носіями електричного заряду, тобто тими частинками, що вільно спрямовано рухаються в електричному полі. У провідниках I роду носіями заряду є електрони, такими провідниками є всі метали та їхні сплави. А розчини та розплави електролітів — це провідники II роду, носіями заряду в них є йони. Тобто метали, як і розчини електролітів, є провідниками електричного струму, але електролітами їх називати не можна, оскільки метали завжди проводять електричний струм завдяки наявності вільних електронів, а електроліти — тільки в розчинах або розплавах, в яких відбувається електролітична дисоціація.
Рівняння електролітичної дисоціації
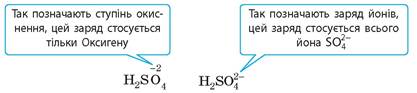
Електролітична дисоціація — це не хімічна реакція, оскільки не відбувається перетворення одних речовин на інші. Але для зручності електролітичну дисоціацію записують у формі рівняння, де замість знака рівності записують стрілку. Записуючи формули йонів у розчині, заряд йонів указують дещо по-іншому, ніж у записі ступеня окиснення: спочатку записують цифрове значення, а потім знак заряду (в однозарядних йонах цифру 1 зазвичай не пишуть).
Наприклад, рівнянням електролітичної дисоціації натрій хлориду є:
![]()
Аналогічно записують рівняння дисоціації кальцій хлориду:
![]()
У водних розчинах електролітів вода — найважливіший учасник процесу дисоціації. Але вода — це середовище, в якому відбувається дисоціація. Під час процесу вода не витрачається й не утворюється, тому в рівняннях електролітичної дисоціації воду не зазначають.
Лінгвістична задача
Хоча грецькою «електрон» означає «бурштин», але сьогодні це слово використовують для позначення всього, що пов'язано з електрикою. За різними джерелами, другий корінь слова «електроліт» походить від грецького слова «літос», яке означає «камінь», або «литос», яке означає «той, що може розчинитися». Зважаючи на це, поясніть зміст терміна «електроліт». Чому, на вашу думку, грецьку назву бурштину використовують для позначення електричних явищ?

Сванте-Август Арреніус (1859—1927)
Видатний шведський хімік та фізик, лауреат Нобелівської премії 1903 року, один із засновників фізичної хімії. У 17 років вступив до Упсальського університету й уже через два роки отримав ступінь бакалавра. Згодом працював у Фізичному інституті академії наук у Стокгольмі. За розробку теорії електролітичної дисоціації 1903 року був нагороджений Нобелівською премією. Арреніус відомий не тільки як учений, але і як автор численних підручників, науково-популярних статей та книг з геофізики, астрономії, біології та медицини. Протягом багатьох років Арреніус займав посаду директора Нобелівського інституту в Стокгольмі.
Для оприлюднення теорії електролітичної дисоціації Арреніусу знадобилася неабияка сміливість. Ідея була вкрай дивною: було неймовірно, що йони виникають не безпосередньо під впливом електричного струму, а просто під час розчинення. До того ж, багато сучасників Арреніуса не розуміли різниці між «атомом» і «йоном» і, почувши, що у водному розчині солі Калію існують йони Калію, одразу різко заперечували: якби таке відбувалося, то утворений калій мав би бурхливо реагувати з водою.
Ключова ідея
Існування електролітів зумовлене можливістю певних речовин розпадатися на йони (катіони та аніони) під час розчинення або розплавляння.
Контрольні запитання
92. Сформулюйте визначення електролітів і неелектролітів. Наведіть приклади речовин.
93. Що таке електролітична дисоціація? Чи можуть під час розчинення електроліту у воді утворитися тільки катіони або тільки аніони? Чому?
94. Випишіть із тексту параграфа основні положення теорії електролітичної дисоціації: 1) щодо розпаду електролітів на йони; 2) щодо руху йонів у електричному полі.
Завдання для засвоєння матеріалу
95. Із наведеного переліку випишіть окремо формули речовин, що є: а) електролітами; б) неелектролітами.
NaI, HBr, O2, СН4, CaCl2, KOH, H2SO4, C12H22O11 (цукор).
96. Яка кількість речовини частинок утвориться в разі розчинення у воді таких речовин кількістю речовини 1 моль: а) гідроген хлорид; б) калій йодид; в) кальцій бромід; г) магній нітрат? Складіть рівняння електролітичної дисоціації цих речовин.
97. Чому не можна ремонтувати електропроводку, стоячи у воді або на вологій поверхні?
98. Як ви вважаєте, чому розчин гідроген хлориду у воді проводить електричний струм, а розчин гідроген хлориду в бензині — ні?
99*. У разі деяких захворювань лікарі рекомендують «поповнити організм електролітами». Про які електроліти йдеться? У який спосіб це можна здійснити? За яких захворювань і з якої причини необхідна така процедура?
Цей контент створено завдяки Міністерству освіти і науки України
