Фізика і астрономія. Рівень стандарту. 11 клас. Головко
Цей підручник можна завантажити у PDF форматі на сайті тут.
§ 10. Електричний струм у рідинах
Опрацювавши цей параграф, ви зможете пояснювати природу електричного струму в електролітах, застосовувати закони електролізу для розв'язування задач, оцінювати перспективи використання електролізу в техніці та технологіях.
ЕЛЕКТРИЧНИЙ СТРУМ У РОЗЧИНАХ І РОЗПЛАВАХ ЕЛЕКТРОЛІТІВ. Одним із поширених видів провідників електрики є електроліти. Їх розчини або розплави є провідниками електричного струму. У розчині під впливом полярних молекул води речовина-електроліт розпадається на позитивно та негативно заряджені йони. Це явище називають електролітичною дисоціацією (рис. 10.1)
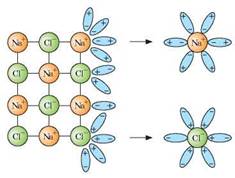
Рис. 10.1. Процес електролітичної дисоціації кухонної солі
Якщо в такому розчині створити електричне поле, то позитивно заряджені йони (катіони) рухатимуться до катода (негативно зарядженого електрода), а негативно заряджені йони (аніони) — до анода (позитивно зарядженого електрода) (рис. 10.2).
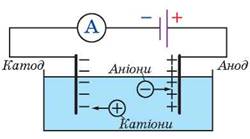
Рис. 10.2. Виникнення електричного струму в розчині електроліту
У розчинах і розплавах електролітів електричний струм створюється позитивними та негативними йонами.
ЕЛЕКТРОЛІЗ. ЗАКОНИ ЕЛЕКТРОЛІЗУ. У постійному за напрямом електричному полі позитивні йони електроліту рухаються до катода, а негативні до анода. Коли катіони стикаються з катодом, вони отримують від нього електрони та відновлюються (наприклад, Cu2+ + 2e → Cu). На аноді негативний йон віддає електрон, тобто відбувається процес окислення (2Cl- → Cl2 + 2e). Отже, проходження електричного струму в розчинах і розплавах електролітів супроводжується виділенням речовини на електродах.
Електроліз — процес виділення речовин на електродах, пов'язаний з окисно-відновними реакціями, що відбуваються під час проходження струму.

Майкл Фарадей (1791-1867), англійський фізик, один із основоположників учення про електромагнетизм, установив закони електролізу
Англійський фізик Майкл Фарадей експериментально встановив, що маса m речовини, яка виділяється на електроді під час електролізу, пропорційна силі струму І та часу t його проходження через електроліт:
m = k · I · t,
де k — електрохімічний еквівалент речовини.
Електрохімічний еквівалент речовини k чисельно дорівнює масі речовини, яка виділяється на електроді за 1 с під час проходження через електроліт струму силою 1 А.
Другий закон Фарадея встановлює залежність між хімічним та електрохімічним еквівалентами. Нагадаємо, що хімічним еквівалентом називають відношення атомних мас речовин M до їх валентностей:
![]()
Електрохімічний еквівалент речовини пропорційний його хімічному еквіваленту:
![]()
де F — коефіцієнт пропорційності, який називають сталою Фарадея:
![]()
Приклад розв'язування задачі на закони електролізу.
Задача 1. Нікелювання поверхні прямокутної деталі площею 48 см2 здійснюється під час проходження струму силою 0,15 А. Визначте товщину шару покриття, якщо електроліз триває 2 год.

Задача 2. Визначте, який найменший заряд повинен мати акумулятор, щоб під час електролізу підкисленої води, густина якої 1,43 кг/м3, вивільнилося 5 л кисню за температури 27 °C і нормального атмосферного тиску?

ВИКОРИСТАННЯ ЕЛЕКТРОЛІЗУ В ТЕХНІЦІ ТА ТЕХНОЛОГІЯХ. Явище електролізу широко використовують у техніці та технологіях. Під час гальваностегії (від гальвано і грец. stego — покриваю) на поверхню металевих виробів наносять покриття методом електролітичного осадження (http://peddumka.edukit.kiev.ua/Files/downloadcenter/QR-Phys11-64.pdf).

Детальніше...
! Головне в цьому параграфі
Електричний струм у розчинах і розплавах електролітів створюється позитивними та негативними йонами. Проходження електричного струму в розчинах і розплавах електролітів супроводжується виділенням речовини на електродах.
Процеси, що відбуваються під час проходження електричного струму через розчини електролітів, називають електролізом. Електрохімічний еквівалент речовини k чисельно дорівнює масі речовини, яка виділяється на електроді за 1 с під час проходження через електроліт струму силою 1 А.
? Знаю, розумію, вмію пояснити
1. Що є носіями електричного струму в електролітах? 2. Дистильована вода не проводить електричний струм. Поясніть, чому вона стає провідником, якщо в ній розчинити солі, кислоти, луги? 3. Сформулюйте закони електролізу Фарадея. 4 Що називають електрохімічним еквівалентом речовини? 5. Який фізичний зміст сталої Фарадея? 6. Як пов'язані електрохімічний еквівалент речовини та її валентність? 7. Чи залежить опір розчинів електролітів від температури? Як саме? 8. Наведіть приклади практичного використання електролізу.
Вправа до § 10
- 1(с). Під час посріблення виробу на катоді за 30 хв осіло 4,55 г срібла. Визначте силу струму.
- 2(с). Під час електролізу мідного купоросу за 1 год виділилося 0,5 кг міді. Площа поверхні електродів становить 7,5 м2. Обчисліть густину струму
![]()
- 3(д). За сили струму 5 А впродовж 10 хв у електролітичній ванні виділилося 1,017 г двовалентного металу. Визначте його атомну масу.
- 4(д). Скільки нікелю виділиться під час електролізу за час t = 1 год і сили струму I = 10 А, якщо відомо, що молярна маса нікелю становить М = 0,0587 кг/моль, а валентність n = 2?
- 5(д). Яку кількість електричної енергії потрібно витратити, щоб під час електролізу розчину азотно-кислого срібла виділилося 500 мг срібла? Різниця потенціалів на електродах становить 4 В.
- 6(в). Для електролізу розчину ZnSO4 необхідно затратити енергії W = 2 кВт · год. Визначте масу m цинку, яка виділиться, якщо напруга дорівнює U = 4 B.
- 7(в). Визначте товщину шару міді, що виділилася за 5 год під час електролізу мідного купоросу, якщо густина струму дорівнює 0,8 А/дм2.
Цей контент створено завдяки Міністерству освіти і науки України
